La narcolepsia es un trastorno neurológico crónico raro (prevalencia: 25-50/100.000 habitantes), que suele aparecer en la edad pediátrica, con manifestaciones atípicas y sin un tratamiento curativo. La narcolepsia de tipo 1, con somnolencia diurna excesiva, episodios de debilidad provocada por emociones (cataplejía), sueño nocturno fragmentado y episodios de parálisis de sueño o alucinaciones relacionadas con el sueño, está causada por la destrucción de neuronas en el hipotálamo y la pérdida de la transmisión hipocretinérgica. En niños, la somnolencia es atípica (siestas prolongadas y no reparadoras) y los episodios de cataplejía son, a menudo, en el territorio facial, con apertura bucal y protrusión de la lengua. Cuando existen factores de riesgo, como cardiopatías congénitas, inmunodeficiencias, trastornos hematológicos, etc., se aconseja la vacunación antigripal en la población pediátrica para evitar complicaciones graves; en los últimos años, con el objetivo de proteger a un amplio rango de la población tras la pandemia de gripe A (A/H1N1) en 2009. Esta vacuna incluye cepas del virus de gripe A/H1N1. En este texto analizamos todas las intervenciones y exponemos las opiniones sobre esta vacunación en menores de edad.
Presentamos el caso de una niña de 9 años que acude con fatiga y somnolencia de dos años de evolución.
Entre sus antecedentes personales destaca una gestación gemelar por fecundación in vitro (con su hermana gemela sana). A la niña se le ha diagnosticado cardiopatía congénita (atresia de la arteria pulmonar, insuficiencia pulmonar y comunicación interauricular de tipo ostium secundum). También ha sufrido un traumatismo craneal (2019) y ha sido intervenida en dos ocasiones: corrección de la cardiopatía y adenoamigdalectomía (2016). Ha cumplido el calendario vacunal según la edad, incluyendo la vacuna antigripal anualmente.
La paciente presenta somnolencia desde dos años antes de nuestra primera consulta, de aparición brusca, en forma de siestas prolongadas, irreprimibles, no reparadoras y que aparecen en clase o caminando.
Por la noche duerme 10,5 horas, concilia bien con 3-4 despertares, somniloquia, bruxismo, sueño agitado, sacudidas en las extremidades y ensoñaciones acompañadas de actividad motora compleja. No describe apneas, episodios sugestivos de parálisis de sueño ni alucinaciones relacionadas con el sueño.
Durante el día, la niña está inquieta, con malestar en las piernas estando en reposo, que aparece al final del día y cede con movimiento. Su rendimiento escolar es muy bueno, pero el ánimo es bajo. Su familia también describe episodios de pérdida de fuerza en las extremidades, llegando a caer al suelo, y en la musculatura facial, con apertura de la boca, protrusión de la lengua y cierre parcial de los párpados. Estos episodios son de breve duración (segundos), no se acompañan de pérdida de consciencia y aparecen tras emociones positivas, con mayor persistencia si se encuentra fatigada o tras un episodio de sueño. Además, ha ganado peso de forma significativa también en los últimos dos años. En su hospital de referencia se ha sospechado una miastenia grave ante estos episodios de debilidad, por lo que se le ingresa en el servicio de neurología infantil, donde se le realizan diferentes pruebas, como test de piridostigmina, electromiograma, electroneurograma, estimulación repetitiva, tomografía axial computarizada craneal y electroencefalograma convencional, que son normales, con determinación de anticuerpos (músculo estriado, músculo liso, MUSK, receptor de la acetilcolina y específicos de la cinasa), todos ellos negativos.
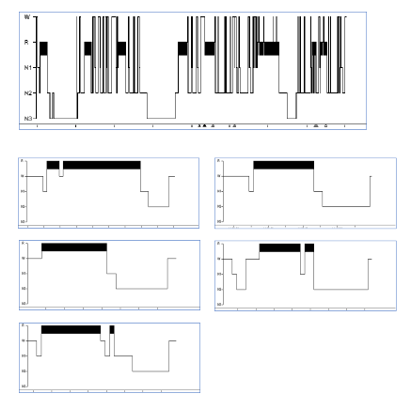
La somnolencia descrita podría estar relacionada con una privación crónica de sueño en el contexto de una posible depresión endógena o provocada por un síndrome de piernas inquietas con posibles movimientos periódicos en las extremidades o parasomnias. Para objetivar este síntoma se realiza un estudio polisomnográfico (Figura) (latencia del sueño, un minuto; latencia del sueño REM, cuatro minutos; eficiencia, 86,2%; 52 despertares; y 31,3 microdespertares/hora, sin eventos respiratorios ni movimientos periódicos en las piernas), seguido de un test de latencias múltiples del sueño (latencia media de sueño de 6,7 minutos; 5/5 comienzos del sueño en fase REM; y latencia media del sueño REM, seis minutos). También se realiza una resonancia magnética craneal, con pequeños focos de gliosis en la sustancia blanca de carácter inespecífico. Aunque el polisomnograma y el test de latencias múltiples del sueño confirman el diagnóstico de narcolepsia de tipo 1, se decide completar el estudio con la determinación de hipocretina 1 en el líquido cefalorraquídeo (10 pg/mL) y tipaje de HLA-DQB1*0602 y HLA-DQA1*0102 (ambos positivos).
Respecto a nuestra paciente, en su hospital de referencia se propone tratamiento con metilfenidato de liberación inmediata (20 mg a las 08:00, 10:00 14:45 horas) y fluoxetina (20 mg/12 horas), que son parcialmente eficaces. La niña es remitida a nuestro centro para iniciar tratamiento con oxibato sódico. En la primera consulta se objetiva obesidad (índice de masa corporal: 24 kg/m2; p98), sin signos de menarquia. Además, se ausculta un soplo pulmonar. La exploración de la orofaringe muestra un Mallampati 2, sin hipertrofia amigdalar (0/IV). Desde nuestra consulta se recomienda cambio de la pauta a formulación de metilfenidato de liberación prolongada y venlafaxina (75 mg/día). Esta pauta debe modificarse, porque esta formulación de metilfenidato es menos eficaz que la de liberación inmediata en dosis repetidas.
Se aconseja volver a tomar la medicación previa, junto con venlafaxina y oxibato sódico (3-8 g/día, dos dosis), que puede controlar la cataplejía, la somnolencia y las manifestaciones nocturnas, con posible pérdida de peso. Permanece así durante cinco meses, pero, al final de este periodo, el oxibato sódico desencadena episodios de sonambulismo, agitación nocturna y sueño fragmentado. Dos meses después se retira la venlafaxina por alteraciones conductuales, con el acuerdo de su psiquiatra, y mejora clínicamente tras la suspensión del tratamiento. Simultáneamente se incrementa progresivamente la dosis de oxibato sódico (hasta 7,5 g diarios, con dosis única de 4 g en los últimos cuatro meses), pero la niña presenta irritabilidad diurna, insomnio de mantenimiento, conductas complejas durante el sueño y menor eficacia de esta medicación. Finalmente, se decide suspender el oxibato sódico tras un año de tratamiento.
Durante la evolución, la niña presenta episodios de ingesta alimentaria compulsiva al final del día, a pesar del oxibato sódico, y se añade un nuevo diagnóstico: trastorno alimentario relacionado con el sueño.
En la actualidad, la niña está pendiente de tratamiento con pitolisant, recientemente aprobado como tratamiento en niños mayores de 6 años con narcolepsia.
Hay que recordar que, en la población pediátrica diagnosticada de narcolepsia de tipo 1, no son infrecuentes los síntomas no neurológicos, como el sobrepeso/obesidad (hasta el 90%, sin causa aparente, como síntoma inicial o asociado a un trastorno de la conducta alimentaria al final del día, en el transcurso de la enfermedad), la pubertad precoz (17%), los síntomas depresivos, o el déficit de atención/hiperactividad.
En esta niña, el diagnóstico ha ocurrido dos años después del inicio de los síntomas, pero muy a menudo pasan más de cinco años, en los que los pacientes no tienen un diagnóstico correcto ni un tratamiento adecuado a causa de la atipicidad de los síntomas o la aparición de comorbilidades. Investigando el inicio de los síntomas, que aparecen de forma brusca, se analiza qué posibles desencadenantes han podido intervenir en este caso. En ausencia de traumatismos, factores estresantes o infecciones amigdalares agudas, se plantea la posible relación con una vacuna. La niña ha recibido las vacunas reglamentarias según la edad, pero la Asociación Española de Pediatría (siguiendo las directrices del Ministerio de Sanidad) recomienda, además, administrar vacunas adicionales que protegen de infecciones intercurrentes, potencialmente graves en niños con patología subyacente. En el caso de la vacuna de la gripe estacional, igualmente en niños y en adultos, esta vacuna también incluye cepas de la variante A/H1N1.
Se debe recordar que, en países del norte de Europa, especialmente en Suecia, la incidencia de narcolepsia de tipo 1 se ha multiplicado significativamente en población pediátrica que ha sido vacunada de gripe A/H1N1 (con coadyuvante AS03) tras la pandemia sufrida en 2009, y con síntomas más llamativos que en los niños no vacunados. Por este motivo, como precaución, la Agencia Europea del Medicamento aconseja no usar vacunas adyuvadas en menores de 20 años.
Se ha postulado que la vacuna de la gripe A/H1N1 podría desencadenar una reacción autoinmunitaria en sujetos susceptibles (HLA-DQB1*0602) o, incluso, la propia infección por el virus de la gripe A/H1N1 ocurrida meses antes del inicio de los síntomas. En este caso, la narcolepsia de tipo 1 sería el resultado de un proceso autoinmunitario mediado por linfocitos T, donde el virus de la gripe A/H1N1 contribuye a desencadenar los síntomas en presencia de los haplotipos HLA-DQA1*01:02~DQB1*06:02 (DQ0602). Este virus, con una presencia geográfica universal y con una distribución estacional, explicaría por qué diferentes grupos étnicos comparten asociaciones genéticas. Respecto a las vacunas, la causa subyacente de este incremento llamativo de nuevos casos pediátricos podría ser el llamado fenómeno de ‘similitud o mimetismo molecular’ (similitudes estructurales compartidas entre los antígenos virales y autoantígenos, como objetivos de las células T y la hipocretina).
Es evidente que, a partir del incremento de la incidencia de narcolepsia de tipo 1 en Europa inmediatamente tras la pandemia de la gripe A/H1N1 en 2009, han surgido estudios epidemiológicos e inmunológicos que intentan explicar esta relación. Comprender los mecanismos inmunológicos que subyacen a este incremento de riesgo en la narcolepsia de tipo 1 es fundamental desde la perspectiva de la salud pública y de los pacientes, porque puede impulsar el diseño de nuevas investigaciones sobre esta enfermedad y, potencialmente, sobre otras enfermedades autoinmunitarias.
La necesidad de la inclusión del virus de la gripe A/H1N1 en la vacunación anual antigripal dependería de la evolución epidemiológica y la aparición de variantes determinaría la composición antigénica del virus anual. Esa pequeña proporción de cepas de gripe A/H1N1 añadida al virus de la gripe estacional tendría el objetivo de proteger de ambas infecciones a toda la población vacunada, pero sería comprensible que surja el temor a un incremento de casos de narcolepsia de tipo 1 en menores de 18 años susceptibles (en relación con el fenómeno de ‘similitud o mimetismo molecular’). En respuesta a esta posible desconfianza, en 2014, los Centers for Diseases Control and Prevention han analizado la aparición de narcolepsia de tipo 1 tras la vacuna de la gripe A/H1N1 y de la gripe estacional, que, en ambos casos, contienen cepas H1N1, y se ha encontrado un riesgo aparente con esta última.
Vacunas sí, vacunas no: el debate está abierto. Frente a los que plantean una restricción en el programa de vacunación de niños y adolescentes con factores de riesgo para controlar la aparición de narcolepsia de tipo 1 o quienes defienden emplear vacunas antigripales elaboradas únicamente con el virus de la gripe estacional, debemos aplicar la sensatez y tener en cuenta que los beneficios de la inmunización superan el riesgo de narcolepsia asociada a la vacunación, que sigue siendo una enfermedad rara.
10.07.23.
La redacción de los casos clínicos que han participado en el I Concurso de casos clínicos ‘Abre los ojos en narcolepsia’ no ha recibido ninguna financiación. La publicación del suplemento ha sido patrocinada por Bioprojet España.
Los autores declaran no tener conflicto de intereses.
Esta biblioteca la componen casos seleccionados a través del concurso Abre los Ojos en Narcolepsia, promovido por Bioprojet España y con el aval de la Sociedad Española del Sueño.
El concurso Abre los Ojos en Narcolepsia tiene
como temática casos clínicos con interés científico y/o asistencial, respecto a su presentación clínica, diagnóstico, abordaje terapéutico, o de cualquier ámbito. Respecto al tratamiento, los casos presentados pueden incluir pacientes de novo, o tratados con medicamentos en combinación o a los que se les haya realizado un cambio en su medicación para tratar la narcolepsia.
La narcolepsia es una enfermedad neurológica, crónica y rara que afecta la capacidad de las personas para regular el sueño. Así, su síntoma más característico es la somnolencia excesiva, que se presenta como una necesidad irresistible de dormir en cualquier momento del día.
Conoce más en: www.lorarodelsueno.es
Un caso clínico favorece una descripción ordenada, tanto de los síntomas como de los acontecimientos que le ocurren a un paciente en el curso de una enfermedad, hasta su tratamiento y evolución, facilitando el aprendizaje continuo del profesional y el manejo de la incertidumbre en la práctica clínica diaria.
Bioprojet es una compañía internacional fundada en 1982 que agrupa investigación académica y desarrollo farmacéutico industrial para diseñar y desarrollar fármacos precursores de nuevos grupos terapéuticos.

BIOPROJET PHARMA
Calle Retamar, 11
28043 Madrid
info@bioprojet.es
anafilaxia@bioprojet.es
narcolepsia@bioprojet.es